در این مقاله پیرامون اینکه کربنات سدیم چیست سخن به میان خواهیم آورد. ابتدا به ساکن می توان گفت که مفهوم یونانی یک عنصر که در حدود ۲۰۰۰ سال رواج داشت، تنها با یکی از تعاریف جدید از عنصر مشترک است که بیان می کند عنصر ها دارای خواص مشخصی هستند. در زمان های گذشته و در قرون وسطا که کیمیا گران، دانش بیشتری در خصوص فرآیند های شیمیایی را پیدا کردند، مفهوم عناصر بنیادی در پاسخ دادن به سوالات این کیمیا گران ناتوان بود. همچنین باید گفت که خصوصیات بنیادی دیگری برای توضیح تغییرات شیمیایی ارائه شد و در نتیجه آن، گوگرد به عنوان نماینده ای برای قابلیت سوختن، جیوه به عنوان فرار و سیال بودن و نمک به عنوان عنصر ضد سوختن معرفی و بنابراین، گوگرد، جیوه و نمک نیز منعکس کننده طبیعت مواد شناخته شدند. لازم به ذکر است که در سال ۱۶۶۱ رابرت بویل به طبیعت بنیادی یک عنصر شیمیایی پی برد. او اظهار داشت که چهار عنصر بنیادی نمی توانند عناصر شیمیایی حقیقی باشند زیرا این عناصر توانایی ترکیب شدن با یکدیگر را برای تشکیل ماده جدید ندارند و نمی توان این عناصر را از مواد مختلف استخراج کرد. بویل بر طبیعت فیزیکی مواد تاکید داشت و آن ها را به ترکیبات جدیدی که ساخته شده بودند مرتبط ساخت. یک عنصر شیمیایی، مادهای است که نمی توان آن را با واکنش های شیمیایی به اجزای سادهتر تقسیم کرد. اگر نگاهی به جدول تناوبی عناصر بیاندازیم متوجه می شویم که در آن، تعداد ۱۱۸ عنصر شیمیایی وجود دارند، اما جالب است بدانید که از این تعداد، ۲۰ درصد آن در طبیعت وجود ندارد و به طور مصنوعی در آزمایشگاه ساخته شده اند. لازم به ذکر است که بدانید از میان عناصر شناخته شده، تعداد ۱۱ عنصر در حالت عادی به صورت گاز قرار دارند. این یازده عنصر عبارتند از: هیدروژن، نیتروژن، اکسیژن، فلوئور، کلر و شش گاز نجیب. برم و جیوه به حالت مایع قرار دارند. البته سزیم و گالیوم در دمای اتاق یا کمی بیشتر از آن ذوب می شوند. بقیه عناصر نیز جامد هستند. عنصر ها می توانند با یکدیگر در آمیزند و ترکیبات شیمیایی را تشکیل دهند. تعداد ترکیبات شناخته شده محدود است و هر روز به آن ها اضافه می شود. از طرف دیگر باید گفت زمانی که تعداد دو یا بیشتر از عناصر با یکدیگر تشکیل یک ترکیب را دهند، ماده حاصل به طور کامل با اجزای سازنده خود تفاوت خواهد داشت. عناصر گازی هیدروژن و اکسیژن را در نظر بگیرید. این دو عنصر که خواص مختلفی دارند با یکدیگر ترکیب می شوند تا مولکول آب را بسازند که ویژگی هایی متفاوت از اجزای سازنده خود دارند. جالب است بدانید آب را نمی توان یک عنصر دانست چراکه به دو عنصر اکسیژن و هیدروژن تقسیم می شود. اما اکسیژن و هیدروژن دو عنصر مختلف هستند زیرا با واکنش های شیمیایی به عناصر دیگر قابل تقسیم نخواهند بود. البته در نظر داشته باشید مواد مختلفی که در طبیعت وجود دارند، شامل مخلوطی از ترکیبات هستند. آب دریا را تصور کنید که مخلوطی از آب و ترکیبات بسیار دیگر است که از میان آن ها می توان به نمک (سدیم کلرید) اشاره کرد. این نکته حائز اهمیت است که مخلوط ها با ترکیبات تفاوت دارند چراکه مخلوط ها را می توان به کمک فرآیند های فیزیکی از یکدیگر جدا کرد. به طور مثال برای جدا سازی آب از دیگر اجزا در مخلوط آب دریا، کافی است تا آن را تبخیر کنید. بعد از روشن شدن مسئله ی عنصر و معمله های شیمایی در این مقاله قصد بر این است که در مورد یکی از مواد شیمیایی پر کاربرد با شما سخن بگوییم. کربنات سدیم چیست؟ کاربرد های آن در صنعت و زندگی روز مره ی ما به چه صورت می باشد؟ و.... در واقع این پرسش هایی می باشد که در ادامه به یکی یکی آن ها پاسخ خواهیم داد. با ارائه توضیحاتی در مورد کربنات سدیم در خدمت شما مخاطبان گرامی در این مقاله هستیم.


ابتدا به ساکن یک مروری کوتاه بر تاریخچه ی پیداش کربنات سدیم خواهیم داشت. حدود ۵۰۰۰ سال پیش برای اولین بار مصریان باستان شکل طبیعی نمک قلیایی ترکیبی شامل کربنات سدیم دکا هیدرات و سدیم بی کربنات را استفاده میکردند. البته اینکه رسوبات معدنی نمک های قلیایی طبیعی، ترکیبی از کربنات سدیم و سدیم بی کربنات است که از کف دریاچه های خشک شده موجود در مصر، از زمان های گذشته استخراج می شده تا در تهیه مومیایی و به عنوان صابون برای شست و شو و نیز ساخت ابتدایی شیشه، مورد استفاده قرار می گرفته است. لازم به ذکر است که بدانید آن ها محصول را از ذخایر تجمعی دریاچه های خشک یا با سوزاندن جلبک دریایی و سایر گیاهان دریایی بازیافت کردند. در واقع رومی ها همچنین از خاکستر سودا، برای پخت نان، ساخت شیشه و برای مقاصد پزشکی استفاده میکردند. شاید برای شما نیز جالب باشد بدانید تا نزدیک به قرن ۲۰، این ماده همچنان مثل زمان مصر باستان، از خاکستر گیاهان بدست می آمده است و به همین دلیل می باشد که آن را Soda می نامیدند. در سال ۱۷۹۱ میلادی، شیمیدان فرانسوی، نیکلاس لبانس، کربنات سدیم را با استفاده از نمک سدیم کلرید، سولفوریک اسید و سنگ آهک (کلسیم کربنات) در حضور زغال تولید کرد. این را در نظر داشته باشید که در روش نیکلاس لبانس، ابتدا سدیم کلرید در سولفوریک اسید جوشانده شده تا به سدیم سولفات و گاز هیدروژن کلرید تبدیل شود، سپس سدیم سولفات تولید شده، به همراه سنگ آهک و زغال خرد شده، حرارت داده میشد تا سودا اش حاصل گردد. در حقیقت با وجود اینکه گاز هیدروژن کلرید (هیدروکلریک اسید) حاصل از این واکنش، از عوامل آلودگی هوا به شمار می رفت، از این روش تا اواخر ۱۸۸۰ میلادی، برای تولید این ماده استفاده می گردیده است.
لازم به ذکر است که بدانید سدیم، عنصر شیمیایی گروه فلز قلیایی جدول تناوبی تعلق دارد. در واقع سدیم یک فلز بسیار نرم نقره ای سفید است. جالب است بدانید سدیم رایج ترین فلز قلیایی و ششمین عنصر فراوان روی زمین است که ۲.۸ درصد از پوسته زمین را تشکیل می دهد. این ماده به وفور در طبیعت در ترکیبات، به ویژه نمک معمولی و با نام کلرید سدیم شناخته می شود که هالیت معدنی را تشکیل می دهد و حدود ۸۰ درصد از ترکیبات حل شده آب دریا را تشکیل می دهد، وجود دارد. لازم به ذکر است از آنجایی که سدیم بسیار واکنش پذیر است، هرگز در حالت آزاد در پوسته زمین وجود ندارد. با این وجود در سال ۱۸۰۷ سر هامفری دیوی اولین کسی بود که سدیم را به شکل عنصری آن تهیه کرد و از الکترولیز برای هیدروکسید سدیم ذوب شده استفاده کرد. سدیم یکی از اجزای مهم تعدادی از مواد سیلیکات مانند فلدسپات و میکا است. ذخایر عظیم سنگ نمک در نقاط مختلف جهان وجود دارد و ذخایر نیترات سدیم در شیلی و پرو وجود دارد. محتوای سدیم دریا تقریبا ۱.۰۵ درصد است که مربوط به غلظت تقریبا ۳ درصد از هالید های سدیم است. سدیم به دو شکل اتمی و یونی در طیف ستارگان از جمله خورشید و محیط بین ستاره ای شناسایی شده است. عموما تجزیه و تحلیل شهاب سنگها نشان می دهد که مواد سیلیکات موجود به ازای هر ۱۰۰ اتم سیلیکون، به طور متوسط ۴.۶ اتم سدیم دارند. شاید برای شما نیز جالب باشد که بدانید سبک تر از آب، سدیم را می توان با چاقو در دمای اتاق برش داد، اما در دمای پایین شکننده است. گرما و الکتریسیته را به راحتی هدایت می کند و اثر فوتوالکتریک (انتشار الکترون ها هنگام قرار گرفتن در معرض نور) را تا حد مشخصی نشان می دهد. این نکته حائز اهمیت است که سدیم از نظر تجاری مهم ترین فلز قلیایی است. به عبارتی می توان گفت که بیشتر فرآیند های تولید سدیم شامل الکترولیز کلرید سدیم مذاب است. این عنصر ارزان و در مقادیر خودروی تانک موجود است، برای تولید افزودنی های بنزین، پلیمر هایی مانند نایلون و لاستیک مصنوعی، دارو ها و تعدادی فلز مانند تانتالیوم، تیتانیوم و سیلیکون مورد استفاده قرار می گیرد. همچنین به طور گسترده ای به عنوان مبدل حرارتی و در لامپ های بخار سدیم به کار گرفته می شود. رنگ زرد لامپ بخار سدیم و شعله سدیم (مبنای یک آزمایش تحلیلی برای سدیم) با دو خط برجسته در قسمت زرد طیف نور مشخص می شود.
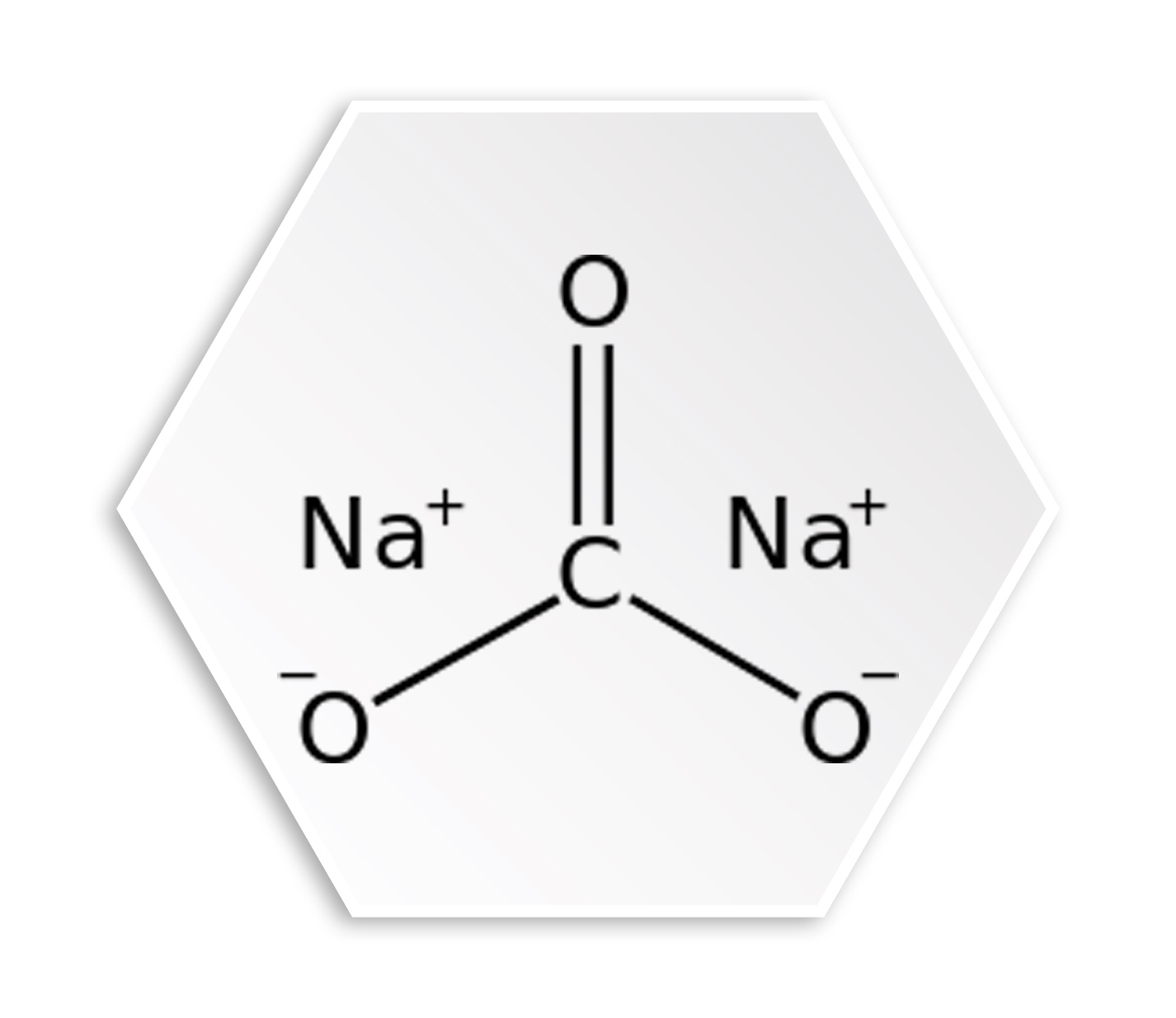

معرفی کربنات سدیم یکی از راه های پیدا کردن شناخت و دانش کافی نسبت به این ماده ی شیمیایی پر کاربرد می باشد. در ابتدا می توان گفت که سدیم بسیار واکنش پذیر است و با تقریبا تمام آنیون های معدنی و آلی (یون های با بار منفی) ترکیبات مختلفی را تشکیل می دهد. به طور معمول حالت اکسیداسیون مثبت یک دارد و الکترون تک ظرفیتی آن به راحتی از دست می رود و کاتیون سدیم بی رنگ تولید میکند. ترکیباتی که حاوی آنیون سدیم هستند نیز سنتز شده اند. این نکته حائز اهمیت است که بدانید ترکیبات سدیم تجاری اصلی کلرید، کربنات و سولفات هستند. مهمترین و آشنا ترین ترکیب سدیم، کلرید سدیم یا نمک معمولی نمک طعام است. اکثر ترکیبات سدیم دیگر به طور مستقیم یا غیرمستقیم از کلرید سدیم تهیه می شوند که در آب دریا، نمک های طبیعی و به صورت سنگ نمک وجود دارد. مقادیر زیادی از کلرید سدیم در تولید سایر مواد شیمیایی سنگین (صنعتی) و همچنین به طور مستقیم برای حذف یخ و برف، برای تهویه آب و در مواد غذایی استفاده می شود. لازم به ذکر است در مورد خواص شیمیایی کربنات سدیم می توان گفت به طور کلی، سدیم عنصری واکنش پذیرتر از لیتیوم است و با آب واکنش می دهد و یک باز قوی، هیدروکسید سدیم تشکیل می دهد. شیمی آن به خوبی بررسی شده است. کربنات سدیم یک ترکیب غیر آلی حاوی نمک سدیم اسید کربنیک است و طعم قلیایی دارد. فرمول شیمیایی آن Na۲CO۳ است. کربنات سدیم در درجه اول به عنوان یک عامل تمیز کننده استفاده می شود. کاربردهای دیگر آن در صنایع شیشه و آجر و همچنین به عنوان یک افزودنی رایج، عامل پیوند دهنده و الکترولیت است.
واکنش با هوا، آب و هیدروژن: همانطور که می دانید سدیم معمولا با هوا کاملا واکنش پذیر است و واکنش پذیری تابعی از رطوبت نسبی یا محتوای بخار آب هوا است. خوردگی سدیم جامد توسط اکسیژن نیز با وجود مقادیر کمی نا خالصی در سدیم تسریع می شود. در هوای معمولی، فلز سدیم واکنش نشان می دهد و یک لایه هیدروکسید سدیم تشکیل می دهد که می تواند به سرعت دی اکسید کربن را از هوا جذب کند و بی کربنات سدیم را تشکیل دهد. سدیم با نیتروژن واکنش نمی دهد، بنابراین به طور معمول سدیم در جو نیتروژن (یا در مایعات بی اثر مانند نفت سفید یا نفتا) غوطه ور می شود. البته به طور قابل توجهی در هوا به عنوان مایع واکنش پذیرتر از جامد است و مایع می تواند در حدود ۱۲۵ درجه سانتی گراد مشتعل شود. جالب است بدانید که در یک جو نسبتا خشک، سدیم بی سر و صدا می سوزد و دود سوزاننده سفید متراکمی از خود خارج می کند که می تواند باعث خفگی و سرفه شود. دمای سوزاندن سدیم به سرعت به بیش از ۸۰۰ درجه سانتی گراد افزایش می یابد و در این شرایط خاموش کردن آتش بسیار دشوار است. در نظر داشته باشید که کپسول های آتش نشانی مخصوص پودر خشک مورد نیاز است، زیرا سدیم با دی اکسید کربن، یک پیشرانه رایج در کپسول های آتش نشانی معمولی، واکنش می دهد. مونوکسید سدیم معمولا از اکسیداسیون سدیم در هوای خشک تشکیل می شود. سوپراکسید را می توان با حرارت دادن سدیم فلزی تا دمای ۳۰۰ درجه سانتی گراد در اتوکلاو (یک ظرف تحت فشار گرم شده) حاوی اکسیژن در فشار بالا تهیه کرد. یکی دیگر از مسیر های سوپراکسید، اکسیداسیون پراکسید سدیم است که برای داشتن سطح وسیعی درمان شده است.
لازم به ذکر است که بدانید سدیمی که به شدت به مونوکسید آلوده است، ممکن است به آسانی با فیلتراسیون خالص شود، زیرا حلالیت اکسید در سدیم مذاب کم است. به عبارتی می توان گفت که این حلالیت کم تا حد قابل توجهی در فرآیند های خالص سازی مداوم سدیم در سیستم های راکتور فلزی مایع بزرگ ورد استفاده قرار می گیرد. روش دوم برای حذف اکسید، به نام تله گذاری سرد، شامل عبور سدیم مذاب از یک بستر خنک شده از مواد است که اکسید می تواند بر روی آن رسوب کند. فیلتراسیون و به دام انداختن سرما نیز در حذف مقادیر نا خالص کربنات، هیدروکسید و هیدرید موثر است. واکنش با آب سدیم مایع که سطح بالایی دارد می تواند انفجاری باشد. با این حال، آزمایش ها و محققان نشان داده اند که سدیم و آب را نمی توان با سرعت کافی برای تولید امواج ضربهای مشخصه مواد منفجره قوی با هم مخلوط کرد. خطرات انفجاری واکنش در درجه اول با گاز هیدروژن تشکیل شده مرتبط است.


لازم به ذکر است که بدانید سدیم خالص در حدود ۱۰۰ درجه سانتی گراد شروع به جذب هیدروژن می کند. سرعت جذب با افزایش دما افزایش می یابد. هیدرید سدیم خالص را می توان در دمای بالاتر از ۳۵۰ درجه سانتی گراد با قرار دادن سدیم در معرض گاز هیدروژن با سرعت جریان بالا تشکیل داد. در دما های بالاتر، تفکیک هیدرید سدیم برای تولید هیدروژن و سدیم مذاب به طور قابل توجهی بیشتر از لیتیوم هیدرید است اما کمی کمتر از هیدرید پتاسیم است. البته در رابطه با معرفی کربنات سدیم می توان گفت که کربنات سدیم برای پلاستیک ها و برخی فلزات مانند آلومینیوم، سرب، روی و برنج خورنده است. کربنات سدیم به نام های سودا شست و شو و خاکستر سودا نیز شناخته می شود. به عبارت دیگر می توان گفت که کربنات سدیم نمک سدیم اسید کربنیک است که خاصیت قلیایی دارد. کربنات سدیم در آب تشکیل اسید کربنیک و هیدروکسید سدیم می دهد. با بخار آب بالاتر از ۴۰۰ درجه سانتی گراد واکنش می دهد و هیدروکسید سدیم و دی اکسید کربن تشکیل می دهد. رطوبت و دی اکسید کربن هوا را جذب کرده و بی کربنات سدیم را تشکیل می دهد. لازم به ذکر است که کربنات سدیم می تواند هم به فلزات و هم به غیر فلزات حمله کند. محلول های آن (غلظت ۳۵ درصد) برای آلومینیوم، سرب، برنج و روی در دمای ۲۱ درجه سانتی گراد خورنده هستند. به عبارت دیگر، فرم جامد آن در رطوبت نسبی صد درصد و دمای معمولی به آلومینیوم خورنده است. محلول های آن برای سایر فلزات رایج مانند فولاد ضد زنگ، فولاد کربنی، چدن نیکل، نیکل و آلیاژ های پایه نیکل خورنده نیستند. محلول های کربنات سدیم به برخی از پلاستیک ها مانند پلی آکریلات ها و پلی سولفیدها نیز حمله می کنند. محلول های آن به آکریلونیتریل-بوتادین-استایرن ، پلی وینیل کلرید کلردار، نایلون، پلی اتیلن، پلی پروپیلن، پلی وینیل کلراید، تفلون، سایر فلوئوروکربن ها و برخی الاستومر ها حمله نمی کنند. کربنات سدیم می تواند باعث شکنندگی سوزاننده و از هم گسیختگی مواد شود و می توان از آن به عنوان بازدارنده رسوب در آب تغذیه دیگ بخار استفاده کرد. کربنات سدیم در عین کاربرد های ویژه ای که در صنعت دارد خطراتی را نیز در پی دارد که باید در نظر داشت. به عبارت دیگر می توان گفت که کربنات سدیم ممکن است خطرات متعددی برای سلامتی و ایمنی ایجاد کند. استنشاق این ماده شیمیایی می تواند منجر به عوارض جانبی مانند تحریک مجاری تنفسی، سرفه، تنگی نفس و ادم ریوی شود. شاید در برخی از موارد نام کربنات سدیم بی آب به گوشتان رسیده باشد. از نظر محققان و کارشناسان منظور از کربنات سدیم بی آب کربنات سدیم هیدراته دارای فرمول Na۲C۰۳.nH۲۰ است. حرارت قوی، کربنات سدیم هیدراته به طور کامل به آب و کربنات سدیم بی آب تجزیه می شود. کربنات سدیم در ذخایر بزرگ طبیعی کشف و در وایومینگ استخراج شده است. همچنین از آب نمک دریاچه در کالیفرنیا با سایر مواد شیمیایی بازیابی شده است.
تفاوت بین کربنات سدیم و بی کربنات سدیم
در نظر داشته باید که پرکاربرد ترین مواد شیمیایی در دنیای امروزی کربنات سدیم و بی کربنات سدیم است. هر دو در سرتاسر دنیا تولید می شوند و کاربرد های مشترکی دارند. کربنات سدیم اغلب در صنایع و کمتر در خانوار ها به کار گرفته می شود. با این حال، بی کربنات سدیم یکی از رایج ترین اقلام خانگی است که در آشپزی استفاده می شود. همچنین جالب است بدانید که به عنوان جوش شیرین شناخته می شود و در پخت و پز و همچنین تمیز کردن بسیار مورد استفاده قرار می گیرد. از طرف شیمی، بی کربنات سدیم و کربنات سدیم اساسا انواع مختلفی از ترکیبات یا نمک های سدیم هستند. یک چیز رایج این است که هر دو حاوی عنصر اصلی به نام سدیم هستند. از نظر ظاهری، هر دو سفید هستند، معمولا جامد هستند اما اغلب به صورت پودر یافت می شوند. علاوه بر این، هر دو به عنوان پایه طبقه بندی می شوند و این دو نیز دارای پیوند یونی هستند. با این وجود، آن ها به طور طبیعی به عنوان ترکیبات سدیم وجود دارند. با این حال، اگرچه نام های کربنات سدیم و بیکربنات سدیم شبیه هم هستند، اما این دو ماده یکسان نیستند و ویژگی ها و کاربرد های زیادی دارند که متفاوت هستند. کربنات سدیم یک نمک پایه است که از یک باز قوی و اسید ضعیف ساخته شده است. هنگامی که با اسید درمان شود به بی کربنات سدیم تبدیل می شود. همچنین به عنوان یک رسانای خوب الکتریسیته عمل می کند. ولی در نقطه ی مقابل بی کربنات سدیم پایه ضعیف تری است و عموما تک پروتیک است. کربنات سدیم به طور معمول در خنثی کردن محلول های اسیدی در زمینه های مختلف استفاده می شود. بی کربنات سدیم همچنین به عنوان خنثی کننده بو، پاک کننده یا لایه بردار و گاهی اوقات به عنوان یک خاموش کننده موقت آتش استفاده می شود. لازم به ذکر است که بدانید اصلی ترین اثر نامطلوب کربنات سدیم بر محیط زیست را می توان تأثیر آن را بر pH محیط در نظر گرفت. لذا تأثیر نا مطلوب کربنات سدیم بر ارگانسیم های موجود در محیط تا حد زیادی تابع ظرفیت بافری محیطی است که این ماده در آن رها می شود. بررسی ها نشان داده اند که کربنات سدیم در غلظت های کمتر از ۱۰۰ میلی گرم بر لیتر بی خطر بوده و در صورتی که این ماده را قبل از انتقال به محیط زیست رقیق کنیم حتی به صورت موضعی نیز موجب کاهش pH نخواهد شد. همچنین می توان گفت بلعیدن کربنات سدیم بدون ضرر است مگر این که به مقدار خیلی زیاد باشد. بو کردن آن نیز ممکن است موجب سوزش بینی و یا گلو شود. در اثر تماس با پوست های حساس ممکن است موجب خارش و یا سوزش پوست گردد. در اثر تماس با چشم امکان ایجاد سوزش و سرخی در چشم وجود دارد. به طور کلی اثرات ایمنی نامطلوب این ماده بیشتر به دلیل ذرات ریز آن می باشد که ممکن است وارد بینی، چشم و یا گلو شوند.


از کاربرد های کربنات سدیم که به صورت قابل توجه می باشد در این قسمت بیان شده است. دو مورد از اولین کاربرد های سدیم فلزی در ساخت سیانید سدیم و پراکسید سدیم بود. مقادیر قابل توجهی در ساخت تترااتیل سرب به عنوان افزودنی بنزین استفاده شد، بازاری که با ظهور بنزین بدون سرب از بین رفت. لازم به ذکر است که بدانید مقادیر قابل توجهی سدیم در ساخت آلکیل سولفات های سدیم به عنوان ماده اصلی در شوینده های مصنوعی مورد استفاده قرار می گیرد. سدیم همچنین به عنوان ماده اولیه در ساخت هیدرید سدیم و بوروهیدرید سدیم به کار می رود. علاوه بر این، سدیم در تولید رنگ ها و واسطه های رنگ، در سنتز عطر ها و در طیف گسترده ای از احیا های آلی استفاده می شود. در خالص سازی هیدروکربن ها و در پلیمریزاسیون هیدروکربن های غیر اشباع بهترین کارایی را دارد. در بسیاری از کاربرد های آلی، استفاده از سدیم به شکل پراکندگی در محیط های مایع هیدروکربنی اشاره نمود. سدیم مذاب یک مایع انتقال حرارت عالی است و به دلیل این خاصیت، به عنوان خنک کننده در راکتور های تولید سریع فلز مایع فلز استفاده می شود. سدیم به طور گسترده در متالورژی به عنوان یک اکسید کننده و به عنوان یک عامل کاهنده برای تهیه کلسیم، زیرکونیوم، تیتانیوم و سایر فلزات واسطه به کار می آید. لازم به ذکر است که بدانید تولید تجاری تیتانیوم شامل کاهش تتراکلرید تیتانیوم با سدیم است. دیگر کاربرد های تجاری عمده کلرید سدیم شامل استفاده از آن در ساخت کلر و هیدروکسید سدیم با تجزیه الکترولیتی و در تولید کربنات سدیم توسط فرآیند Solvay است. به عبارتی می توان گفت که الکترولیز کلرید سدیم آبی باعث تولید هیپوکلریت سدیم، ترکیبی از سدیم، اکسیژن و کلر می شود که به مقدار زیاد در سفید کننده کلر خانگی استفاده می شود. هیپوکلریت سدیم همچنین به عنوان سفید کننده صنعتی برای خمیر کاغذ و منسوجات، در جهت کلر زنی آب و در برخی از دارو های دارویی به عنوان ضد عفونی کننده و قارچ کش به کار گرفته می شود. در نظر داشته باشید که این یک ترکیب ناپایدار است که فقط در محلول آبی شناخته شده است. کربنات ها حاوی یون کربنات هستند. به طور کلی می توان گفت که بی کربنات سدیم، که به آن کربنات هیدروژن سدیم یا بی کربنات سودا، نیز می گویند، منبع دی اکسید کربن است و به عنوان یک ماده در پودر های پخت، نمک های جوشان و نوشیدنی ها و به عنوان ماده اصلی کپسول های آتش نشانی خشک شیمیایی استفاده می شود. . قلیایی بودن خفیف آن، آن را برای درمان اسیدیته معده یا ادرار و اسیدوز مفید می کند. همچنین در فرآیند های صنعتی خاصی مانند دباغی و تهیه پشم بهترین کارایی را دارد. البته در رابطه با کاربرد های کربنات سدیم می توان گفت که دارای ترکیبات اصلی می باشد که در ادامه به هر یک از آن ها خواهیم پرداخت.
• کربنات سدیم، یا خاکستر سودا (Na۲CO۳): به طور گسترده در طبیعت توزیع شده است، به عنوان اجزای تشکیل دهنده آب های معدنی و به عنوان مواد معدنی جامد ناترون، ترونا، و ترموناتیت. مقادیر زیادی از این نمک قلیایی در ساخت شیشه، شوینده ها و پاک کننده ها استفاده می شود. کربنات سدیم با دی اکسید کربن تصفیه می شود تا بی کربنات سدیم تولید شود. فرم مونوهیدرات کربنات سدیم، به طور گسترده در عکاسی به عنوان یک ماده تشکیل دهنده در توسعه دهندگان به کار گرفته می شود.
• سولفات سدیم (Na۲SO۴): یک جامد یا پودر کریستالی سفید رنگ است که در ساخت کاغذ کرافت، مقوا، شیشه و مواد شوینده و به عنوان ماده اولیه برای تولید مواد شیمیایی مختلف استفاده می شود. لازم به ذکر است این ماده یا از رسوبات مواد معدنی سولفات سدیم میرابیلیت و تناردیت و یا به صورت مصنوعی از طریق تصفیه کلرید سدیم با اسید سولفوریک به دست می آید. با این وجود محصول متبلور یک هیدرات است که به طور معمول به عنوان نمک گلوبر شناخته می شود. به عبارت دیگر می توان گفت که تیوسولفات سدیم (هیپو سولفیت سدیم)، توسط عکاسان برای تعمیر نگاتیو های توسعه یافته و چاپ بهنرین کارایی را به همراه خواهد داشت. این ماده با حل بخشی از نمک های نقره پوشیده شده روی فیلم عمل می کند که با قرار گرفتن در معرض نور بدون تغییر باقی می مانند.
• هیدروکسید سدیم (NaOH): یک جامد کریستالی سفید خورنده است که به راحتی رطوبت را تا زمان حل شدن جذب می کند. هیدروکسید سدیم که به طور معمول سود سوزآور یا لیمو نامیده می شود، پر مصرف ترین قلیایی صنعتی است. برای بافت حیوانی و گیاهی بسیار خورنده است. این نکته را در نظر داشته باشید که محلول های قلیایی که هنگام حل شدن در آب تشکیل می شود، اسید ها را در فرآیند های تجاری مختلف خنثی می کند. در پالایش نفت، اسید های سولفوریک و آلی را حذف می کند. در صابون سازی با اسید های چرب واکنش نشان می دهد. محلول های سدیم هیدروکسید در تصفیه سلولز و در ساخت بسیاری از مواد شیمیایی استفاده می شود.
• نیترات سدیم یا نیترات سودا (NaNO۳): عموما به دلیل ذخایر معدنی آن در شمال شیلی، منبع اصلی، نمک شور شیلی نامیده می شود. نیترات سدیم به عنوان کود نیتروژن دار و جزء دینامیت مورد استفاده قرار می گیرد.

برخی از کاربرد های متداول کربنات سدیم عبارتند از :جاذب ها، نرم کننده آب، افزودنی مواد شوینده برای کف کردن موثرتر، مواد سفید کننده، پرکننده ها، عوامل تکمیل کننده، واسطه ها،رنگدانه ها، کمک های فرآوری، مخصوص تولید نفت، عوامل جدا سازی جامدات و حلال ها می باشد. به طور کلی شامل موارد زیر نیز می باشد:
• به کار بردن در ساخت مواد شوینده، صابون، کاغذ
• همچنین استفاده در ساخت شیشه آب (سیلیکات سدیم)، بوراکس، فسفات سدیم و بسیاری دیگر از ترکیبات سدیم
• به عنوان یک عامل مرطوب کننده در صنعت آجر
• به عنوان یک عامل ساینده و کف کننده در خمیر دندان
• به عنوان یک اصلاح کننده pH
• آب سخت که از یون های منیزیم و کلسیم تشکیل شده است و توسط کربنات رسوب می کند به عنوان نرم کننده آب استفاده می شود.
• به عنوان یک معرف آزمایشگاهی برای استاندارد کردن اسیدها و به عنوان یک معرف تحلیلی.
به طور کلی می توان گفت عاملی که باعث تفاوت نوع سنگین و سبک کربنات سدیم می شود، چگالی و اندازه کریستال هایی است که در قالب پودری سفید رنگ دیده می شوند. در حقیقت فرم سبک و سنگین کربنات سدیم به غیر از ویژگی های فیزیکی که گفته شد تفاوت دیگری با یکدیگر ندارند. فرم سبک همانطور که از نامش نیز پیداست چگالی کمتری داشته و اندازه ذرات تشکیل دهنده آن نیز کوچکتر از فرم سنگین می باشد. در ادامه برای آشنایی هر چه بیشتر شما به شرح کامل انواع کربنات سدیم می پردازیم:
کربنات سدیم سبک: لازم به ذکر است که کربنات سدیم سبک به طور سنتی جایی که شیمی در محلول مورد نیاز است، مور استفاده قرار می گیرد. این ماده به عنوان تنظیم کننده ی میزان اسیدی بودن در بسیاری از صنایع شیمیایی نیز کاربرد دارد. فرم سبک و سنگین کربنات سدیم یا همان سودا اش دارای وزن مولکولی یکسانی هستند (۱۰۵.۹۹)، حلالیت مشابهی دارند (حداکثر ۳۳.۲ درصد در دمای ۳۴.۴ درجه سانتی گراد) و هنگام انحلال در آب نیز محلولی با میزان PH یکسانی را تولید می کنند. در واقع می توان گفت که کربنات سدیم سبک دارای چگالی معادل ۰.۷۷ گرم بر سانتی متر مکعب بوده که تقریبا نصف چگالی فرم سنگین به حساب می آید. جالب است بدانید هنگام اندازه گیری از نظر وزنی، مقدار وزن شده از فرم سبک با فرم سنگین برابر خواهد بود. این در حالی است که اندازه گیری این ترکیب ها از نظر حجمی متفاوت خواهد بود. به این صورت که با اندازه گیری حجمی یکسان از این دو ترکیب، فرم سبک همواره وزن بیشتری از فرم سنگین خواهد داشت. این نکته را در نظر داشته باشید که اندازه کوچک دانه های سودا اش سبک موجب ایجاد پودری یکدست و نرم شده و تفاوت ظاهری آن با سودا اش سنگین به سادگی و حتی با چشم نیز قابل رؤیت می باشد. لازم به ذکر است این پودر فاقد بو یا خاصیت سمی بوده و به عنوان یک ترکیب پایدار و غیر قابل اشتعال شناخته شده است که تا حدود ۰.۵ درصد حاوی کلرید سدیم می باشد. شاید برای شما نیز جالبباشد که بدانید جوش شیرین از ترکیب سودا اش سبک با مولکول های آب اضافی تولید شده و به طور وسیعی در صنایع تولیدی مواد شوینده و صابون ها مورد استفاده قرار می گیرد تا خاصیت شویندگی آن ها را تا حد قابل توجهی افزایش دهد. به طور کلی حدود ۵۰ درصد از کاربرد های کربنات سدیم در حوزه صنایع شیشه متمرکز شده و به فرم سنگین این ترکیب مربوط می شود. البته مابقی کاربرد کربنات سدیم سبک و سودا اش با درصد هایی پراکنده در زمینه های چون صنایع غذایی و دارویی، تولید مواد شوینده، برطرف کردن سختی آب، تولید مواد شیمیایی و… به فرم سبک یا به گرید کربنات سدیم خوراکی مرتبط می باشد


کربنات سدیم سنگین: کربنات سدیم سنگین یکی از نمونه های کربنات سدیم می باشد. به عبارتی می توان گفت که کربنات سدیم سنگین به عنوان نمونه ای از انواع باز ها از هیدراسیون کربنات سدیم سبک به مونوهیدرات و سپس دهیدراسیون تهیه شده است. حذف آب برای بهبود روند تولید راندمان یک محصول با شکل و اندازه و تراکم کریستالی می باشد. این را در نظر داشته باشید که به غیر از این روش، با استفاده از فرآیند سلوی نیز کربنات سدیم را در مقیاس صنعتی تولید می کنند. در این روش کربنات سدیم را از سنگ آهک یا همان کربنات کلسیم، آمونیاک و کلرید سدیم بدست می آورند. از جمله سایر فرآیند های شیمیایی که در طی تهیه این ترکیب مورد استفاده قرار می گیرند می توان به للانک و هو اشاره نمود. لازم به ذکر است که بدانید کربنات سدیم سنگین از سنگ ترون تهیه شده است و برای تولید شیشه، صابون، خمیر کاغذ، صنایع شیمیایی و تصفیه آب از آن به کار گرفته می شود. در حقیقت می توان گفت که کاربرد اصلی این محصول به صورت جامد، به خصوص در ساخت شیشه به عنوان یک شار در ذوب سیلیس استفاده می کنند. البته دلیل اصلی استفاده از کربنات سدیم سنگین برای تولید شیشه این می باشد که نوع سنگین کربنات سدیم دارای ذراتی نسبتا درشت بوده و چگالی بالاتری نسبت به فرم سبک خود دارد. این موضوع موجب شده تا این ترکیب به طور عمده ای در صنایع شیشه و همچنین در تهیه سرامیک، ظروف شیشه ای و به ویژه شیشه های سیلیس سودا-آهک مورد استفاده قرار گیرد. در صنایع شیشه این ترکیب را به عنوان ماده اولیه و اصلی ترین جزء در فرآیند تولید شیشه می شناسند، چرا که این ترکیب به طور طبیعی دمای ذوب را کاهش داده و خاصیت قلیایی آن نیز در شکل دهی بهتر به شیشه کمک می کند. حال می توانیم تفاوت کربنات سدیم سبک و سنگین را تشخیص دهیم.
همانطور که می دانید کربنات سدیم یک نمک دیازونیوم اسید کربنیک با فرمول شیمیایی Na۲CO۳ است. این ترکیب معدنی محلول در آب است و هنگامی که در آب حل می شود اسید کربنیک و هیدروکسید سدیم را تشکیل می دهد. در حالت خالص، پودر سفید و بی بو است. این یک پایه قوی است و به عنوان یک آنتی اسید عمل می کند. کربنات سدیم را می توان با چهار فرآیند تولید کرد: فرآیند Solvay، فرآیند Labnac، فرآیند دوگانه، فرآیند الکترولیتی.
۱- تولید کربنات سدیم با سنگ ترونا: لازم به ذکر است که بدانید ترونا، یعنی تری سدیم هیدروژن دی کربنات دی هیدرات در مناطق مختلفی از ایالات متحده استخراج می شود و تمام کربنات سدیم نیاز آن کشور را تأمین می کند. به عبارتی می توان گفت که رسوبات عظیم و طبیعی از آن در سال ۱۹۳۸ در نزدیکی گرین ریور یافت شده و استخراج معادن در آمریکای شمالی بیشتر با توجه به جنبه اقتصادی و نه تولید صنعتی صورت گرفت. این ماده از دریاچه های قلیایی نیز به دست میآید، همچون دریاچه ی ماگادی در کنیا که البته با استفاده از طریق فرآیند لایروبی با روش های ابتدایی به دست می آید و به طور طبیعی تجدید می شود. بنابراین هیچگاه این منبع طبیعی پایان نمی پذیرد. همانطور که می دانید بسیاری از گیاهان شورپسند که در آب های شور زیست می کنند و در مقابل آب شور مقاوم اند و می توانند انواع نا خالص کربنات سدیم را به ما بدهند و این منابع شکل رایج و کنونی مورد استفاده در اروپا و سایر مناطق تا قرن ۱۹ بود. البته گیاهان خشکی زی مانند درخت آشنا و نیز علف شوره یا خزه یا نوعی جلبک دریایی به نام کتانجک ابتدا جمع آوری شده و پس از خشک کردن سوزانده می شدند. به عبارتی خاکستر حاصل با آب شسته می شد تا محلول قلیایی تشکیل شود. این محلول پی از جوشانده شدن و خشک شدن محصول نهایی حاصل می گردد که Soda Ash نامیده می شود. این نام قدیمی برگرفته از منبع اولیه گیاهی آن است که یک بوته یک ساله به نام سالسالا سودا است. لازم به ذکر است که غلظت کربنات سدیم موجود در بازه های مختلف دارای گسترده ای می باشد. منابع گیاهی و جلبک مورد استفاده برای شودا اش، و نیز برای پتاس های قلیایی مرتبط، بهطور افزاینده ای تا پایان قرن ۱۸ ناکافی به نظر می رسیدند و جستجو برای یافتن راه های تجاری و پایدار برای ساخت و سنتز این ماده از نمک ها و سایر مواد شیمیایی روز به روز گسترش می یافت.


۲ . تولید کربنات سدیم با روش leblanc: یکی دیگر از روش های تولید کربنات سدیم به روش leblanc می باشد که در این مرحله برخلاف روش قبل این یک روش کاملا مصنوعی است که توسط واکنش نمک با اسید سولفوریک ایجاد می شود، گفتنی است که در انجام این روش مشکلاتی از قبیل صرف هزینه های بالا و ایجاد آلودگی زیاد وجود دارد که نمی شود آن ها را نادیده گرفت.
۳ . تولید کربنات سدیم با روش solvay: لازم به ذکر است که با توجه به مشکلاتی که در روش قبلی ذکر کردیم شیمی دانی به اسم ارنست سلوی توانست روشی بهتر جهت تولید کربنات سدیم ایجاد کند که مشکلات کمتری در بر داشته باشد، این شخص توانست از طریق واکنش دادن ماده آمونیاک و دی اکسید کربن با آب کربنات سدیمی ایجاد کند که مشکلات فرآیند قبلی را نداشته باشد. بدین صورت که در این فرآیند دی اکسید کربن و آمونیاک به محلول سرد اشباع شده از کلرید سدیم منتقل می شود. در واکنش هایی که روی می دهند، کربنات هیدروژن سدیم تشکیل می شود که در حضور یون های سدیم بسیار کمی محلول است، تقریبا به طور کامل رسوب میکند. با فیلتراسیون حذف می شود و برای تولید کربنات سدیم مشتعل می شود. مواد تشکیل دهنده این فرآیند به راحتی در دسترس و ارزان هستند. در واقع این موارد نمک، آمونیاک و سنگ آهک هستند. در این فرآیند، کلسیم کلرید یک محصول جانبی مهم به دست آمده است.
۴ . تولید کربنات سدیم با روش hou: این روش را نیز توسط شیمی دان چینی به نام Hou Debang در دهه ی ۱۹۳۰ معرفی شد. که در آن از طریق پمپ کردن بخار دی اکسید کربن و ماده اشباع شده کلرید سدیم و همینطور ماده آمونیاک، موادی به نام بی کربنات سدیم را به وجود آورد. در واقع بدین صورت می توان بیان کرد که این فرآیند در مراحل اولیه مشابه فرآیند سولوای است. اما به جای واکنش دادن محلول باقی مانده با آهک، کربن دیاکسید و آمونیاک یک محلول تشکیل میدهند و سدیم کلرید هنگامی که دما به حد ۴۰ درجه سانتی گراد رسید به محلول اضافه میشود و سپس محلول تا ۱۰ درجه سانتی گراد سرد می شود. در این مرحله آمونیوم کلرید ته نشین شده و با فیلتر گذاری جدا میشود، و در ادامه محلول مجددا برای تولید سدیم بی کربنات به کار گرفته میشود. این روش مشکل تولید کلسیم کلرید را حل کرده و از محصول جانبی آمونیوم کلرید نیز جهت کود دهی مورد استفاده قرار می دهد. این روش، در حقیقت یکی از روش های روز تولید سدیم کربنات در صنایع کنونی جهان به شمار می رود.
ساختار مولکول های کربنات سدیم که می توان اشاره کرد که هر مولکول کربنات سدیم دارای ۲ اتم سدیم، ۳ اتم اکسیژن و یک اتم کربن است. هر کاتیون سدیم دارای بار ۱+ است در حالی که آنیون کربنات چند اتمی دارای بار خالص قدر ۲- است. بنابراین، کربنات سدیم یک مولکول با بار خنثی است. لازم به ذکر است که بدانید قیمت کربنات سدیم در بازار برحسب درصد خلوص، حجم، نرخ ارز و کشور تولید کننده متفاوت است. لدا شما عزیزان و کابران می توانید با مشاوران و کارشناسان نرمال لابو تماس حاصل نمایید و از لیست قیمت های نهایی کربنات های سدیم و انواع آن ها مطلع شوید. این نکته حائز اهمیت است که از مهم ترین برند های کربنات سدیم میتوان به برند کاوه، کاوه سودا، سمنان و کربنات سدیم ازبک اشاره کرد که تمامی این محصولات آن ها در فروشگاه اینترنتی نرمال لابو موجود می باشد.


کربنات سدیم یک ترکیب شیمیایی معدنی است. کربنات سدیم چیزی است که معمولا به عنوان خاکستر سودا شناخته می شود. خاکستر سودا از ترونا استخراج می شود. ترونا یک نمک مضاعف حاوی کربنات سدیم و کربنات هیدروژن سدیم است که در نتیجه یک سری فرآیند های تبخیر در دریاچه ها به وجود آمده است. کربنات سدیم که اغلب به آن سودای شست و شو یا خاکستر سودا می گویند، مهم ترین ماده شیمیایی اساسی است. مزیت بزرگ آن نسبت به هیدروکسید سدیم این است که خورنده نیست و بنابراین حمل و نقل آن ایمن تر است. سودا اش را در مکانی خشک، خنک، دور از نور خورشید و با تهویه مناسب نگه دارید. این ترکیب را از هر گونه آسیب فیزیکی حفظ کنید و از بسته بودن در ظرف مطمئن شوید. کربنات سدیم در کیسه های ۵۰ کیلوگرمی و جامبو به فروش می رسند. شما عزیزان و کاربران محترم می توانید از طریق فروشگاه اینترنتی نرمال لابو نسبت به خرید کربنات سدیم اقدام نمایید. فروشگاه اینترنتی نرمال لابو این افتخار را دراد تا بهترین محصولات شیمی را با کبفبت تضمین شده به سراسر کشور ارسال کند. شما می توانید از طریق تلفنی و اینترنتی خرید کربنات سدیم را انجام دهید تا برای شما در کوتاه ترین زمان ممکن ارسال گردد. همچنین کارشناسان نرمال لابو در خدمت شما عزیزان و کاربران محترم می باشند تا در راستاس خرید این محصول و سایر محصولات مورد نظرتان شما را راهنمایی و مشاوره بدهند تا بتوانید خریدی لذت بخش را تجربه کنید.
همانطور که می دانید یکی از پر کاربرد ترین مواد در صنعت، کربنات سدیم است. این ماده گستره کاربرد فراوانی در صنعت داشته و در صنایع مختلفی به کار گرفته میشود. همچنین به نظر میرسد در سال های گذشته با ورود برخی تکنولوژی های جدید کاربرد های کربنات سدیم فراتر از آنچه که هست شود. همانطور که قبلا نیز به این اشاره شد خاکستر سودا نام تجاری کربنات سدیم می باشد. این ماده در جامعه با اسامی دیگری مثل دو سود، کریستال سودا و سودای شست و شوی نیز شناخته می شود. کربنات سدیم به صورت کربنات سنگین و سبک نیز تولید شده است. این ترکیب شیمیایی بی نظیر به طور کلی در چهار روش تولید و عرضه می شود که در کارنجات های مختلف بسته بندی و به بازار عرضه می گردد. قیمت های آن با توجه به مواد اولیه ی و بسته بندی های آن با یکدیگر متفاوت می باشد. لذا فروشگاه اینترتی نرمال لابو تمامی این امکانات را برای شما عزیزان و خریداران فراهم نموده تا به راحتی بتوانید خرید انواع کربنات سدیم و سایر مواد شیمیایی را داشته باشید.
